AGO-OVAR 26 / ENGOT-ov54 / Swiss-GO-2 / MATAO
Erhaltungstherapie mit Aromatasehemmer für Patientinnen mit epithelialem Ovarialkarzinom
Eine Phase III Studie einschließlich der Low-Grade Ovarialkarzinom Substudie
 Was wird in dieser Studie untersucht?
Was wird in dieser Studie untersucht?
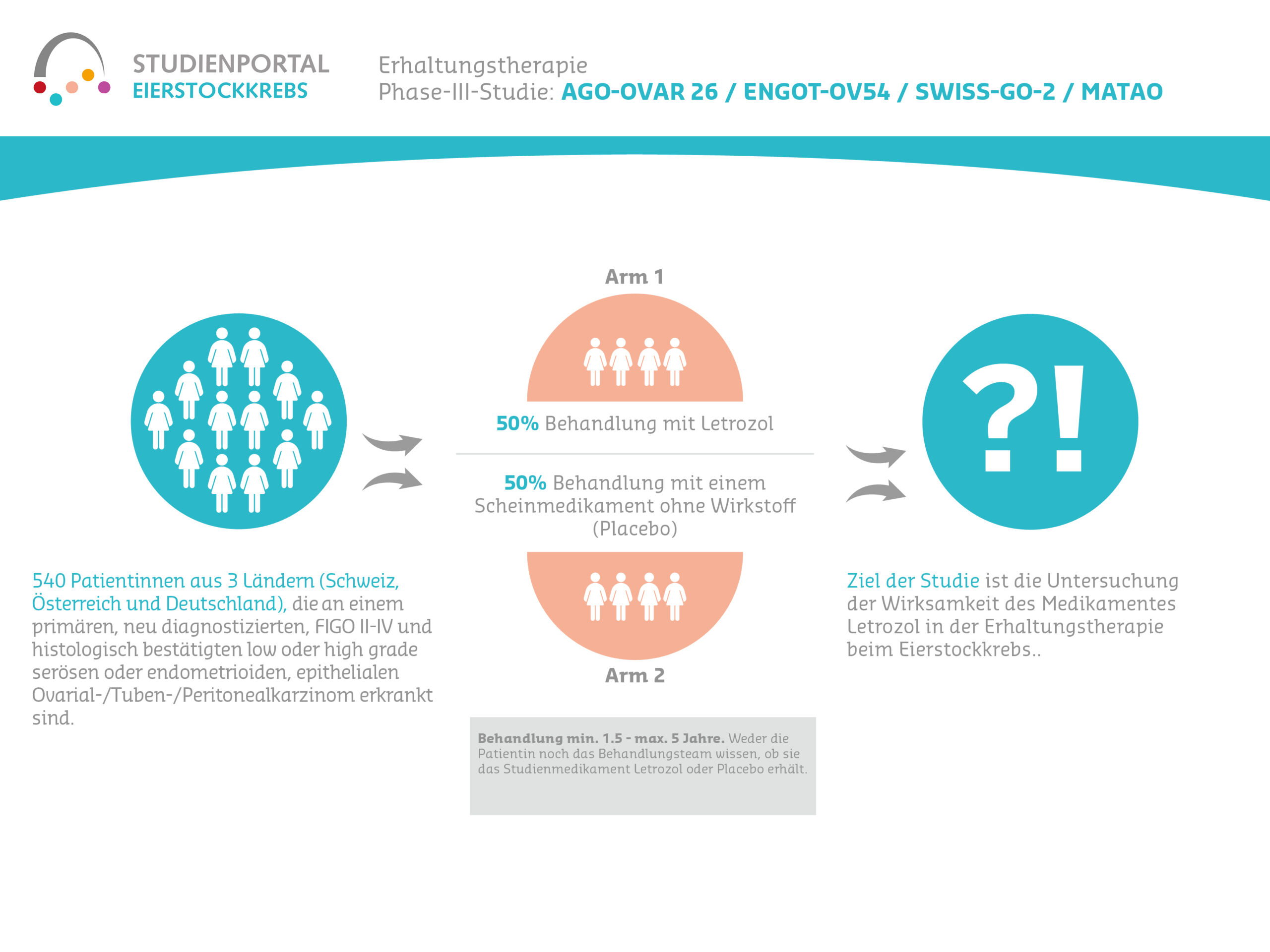
Es handelt sich um eine randomisierte, doppelblinde, Placebo-kontrollierte multizentrische Phase III Studie, die Patientinnen mit einem Ovarialkarzinom einschließt (high grade: MATAO und low-grade: LOGOS). In dieser Studie soll die Wirksamkeit des Medikamentes Letrozol in der Erhaltungstherapie untersucht werden. Bisher ist das Medikament noch kein Standardmedikament bei der Behandlung des Ovarialkarzinoms, und so ist es ethisch vertretbar, das Medikament nicht allen Patientinnen zu geben. Es erfolgt eine zufällige Zuteilung und 50% der Patientinnen erhalten die Behandlung mit Letrozol und 50% der Patientinnen erhalten ein Scheinmedikament ohne Wirkstoff (Placebo). Die Medikation wird über eine Minimaldauer von 1.5 Jahren und maximal bis zu 5 Jahren als tägliche Tablette verabreicht.
Was ist das Ziel der Studie?
Ziel der MATAO (LOGOS) Studie ist die Untersuchung einer spezifischen Behandlung von Eierstockkrebs, welcher explizit Östrogen-Rezeptoren auf der Tumoroberfläche trägt. Es wird untersucht, ob Letrozol, ein Medikament, welches routinemäßig in der Behandlung von Brustkrebs eingesetzt wird, auch bei dieser Art von Eierstockkrebs einen Rückfall verhindern kann.
Wie ist der Ablauf der Studie?
Die Studie wird mit rund 540 Teilnehmerinnen in 3 Ländern (Schweiz, Österreich und Deutschland) durchgeführt. Vor Behandlungsbeginn werden bereits vorliegende Tumorproben der Patientinnen auf das Vorhandensein des Östrogenrezeptors getestet. Sind die Östrogen-Rezeptoren auf der Tumoroberfläche nachweisbar, ist die erste Voraussetzung erfüllt und die Patientin erhält eine schriftliche wie auch mündliche Informationen über die MATAO Studie.
Falls sich die Patientin für eine Teilnahme an der Studie entscheidet, muss dazu eine weitere Einwilligungserklärung unterzeichnet werden. Anhand verschiedener Ein- und Ausschlusskriterien wird erst im Anschluss an die Standardtherapien (in der Regel die Operation und die Chemotherapie) überprüft, ob die Patientin für die Teilnahme an der Studie geeignet ist. Falls die Patientin eine geeignete Kandidatin für die Studie ist, erfolgt der Einschluss in die Studie über eine Randomisierung, das heißt ein Computerprogramm entscheidet zufällig, ob sie das Medikament Letrozol oder Placebo erhält. Weder die Patientin noch das Behandlungsteam wissen, ob sie das Studienmedikament Letrozol oder Placebo erhält (doppelblindes Design). Damit sollen mögliche systematische Fehler ausgeschlossen werden¸ die zu einer Verzerrung von Studienresultaten führen können. Zur Überwachung der Gesundheit und Lebensqualität und zur Beurteilung des untersuchten Medikamentes werden in der Studie verschiedene Methoden eingesetzt:
- Die Patientinnen werden regelmäßig gebeten Fragebögen auszufüllen (alle 3 bzw. 6 Monate entsprechend den Routine-Visiten), mit denen die Lebensqualität und die Nebenwirkungen des Medikamentes erfasst werden.
- Zur Aufzeichnung der gesundheitsbezogenen Daten außerhalb des klinischen Umfelds erhalten die Patientinnen, die über ein Smartphone mit einem kompatiblen Betriebssystem verfügen und sich dazu bereit erklären, eine Fitnessuhr zur Aufzeichnung ihrer täglichen Schritte und Herzfrequenz, sowie einem Blutdruckmessgerät in Form einer klassischen Oberarm-Manschette. Diese kann mit der Fitnessuhr vernetzt und zur täglichen Blutdruckmessung verwendet werden. Es werden nur Mittelwerte der Daten ausgelesen und verwendet. Beide Geräte sollten jeweils für mindestens eine Woche vor jeder Visite verwendet werden.
- Die Daten werden regelmäßig bei den Routine-Visiten (alle 3 bzw. 6 Monate) dokumentiert und später ausgewertet. Wie lange die Studie für die einzelne Patientin insgesamt dauert ist schwer vorauszusagen. Die Behandlungsphase der Studie beträgt maximal 5 Jahre, je nachdem, wann sie in die Studie eingeschlossen wird sowie ob und wann sie einen Rückfall der Erkrankung erleidet oder das Prüfpräparat nicht verträgt. Durch das Studiendesign erhält aber jede Patientin unabhängig vom Zeitpunkt des Einschlusses das Studienmedikament für mindestens 1.5 Jahre. Anschließend wird der Überlebensstatus halbjährlich noch mindestens 5 bis maximal 7 Jahre nachverfolgt.
Gibt es Risiken?
Über mögliche Risiken bzw. Nebenwirkungen, die mit der Teilnahme verbunden sind, werden Sie im Rahmen eines Aufklärungsgesprächs informiert.
Teilnahmevoraussetzungen
An dieser Studie können Frauen im Alter ab 18 Jahren teilnehmen, die
- bereit und in der Lage sind, an den Studienvisiten teilzunehmen und alle studienrelevanten Prozeduren zu verstehen
- an einem primären, neu diagnostizierten, FIGO II-IV und histologisch bestätigten low oder high grade serösen oder endometrioiden epithelialen Ovarial-/Tuben-/Peritonealkarzinom erkrankt sind
- bei denen eine Operation zur Tumorentfernung durchgeführt wurde
- einen ECOG-Leistungsstatus 0-2 aufweisen.
- Paraffin-eingebettetes Tumorgewebe oder einen Zellblock (aus Aszites) zur Verfügung stellen können
- deren Tumor eine positive Östrogenrezeptor-Expression (≥ 1%) aufweist
- die mindestens 4 Zyklen einer platinbasierten Chemotherapie (neoadjuvant erlaubt) erhalten
- nicht mehr gebärfähig sind (die eine operative oder Strahlen-Sterilisation durchlaufen haben oder eine Resektion vor dem Beginn der Studienbehandlung durchlaufen).
Darüber hinaus gibt es aber auch noch weitere Kriterien, die für eine Teilnahme an der Studie erfüllt sein müssen. Interessierte Patientinnen sollten mit ihren Ärzt:innen an einem Studienzentrum sprechen, welche prüfen können, ob sie für diese Studie in Frage kommen.
Wo kann ich an der Studien teilnehmen?
Zuletzt aktualisiert 10.07.2024.




