NOGGO ov54 - İzci 1
Başlangıç tedavisi gören yumurtalık kanserli hastaların günlük rutinlerinden veri toplamaya yönelik gözlemsel çalışma
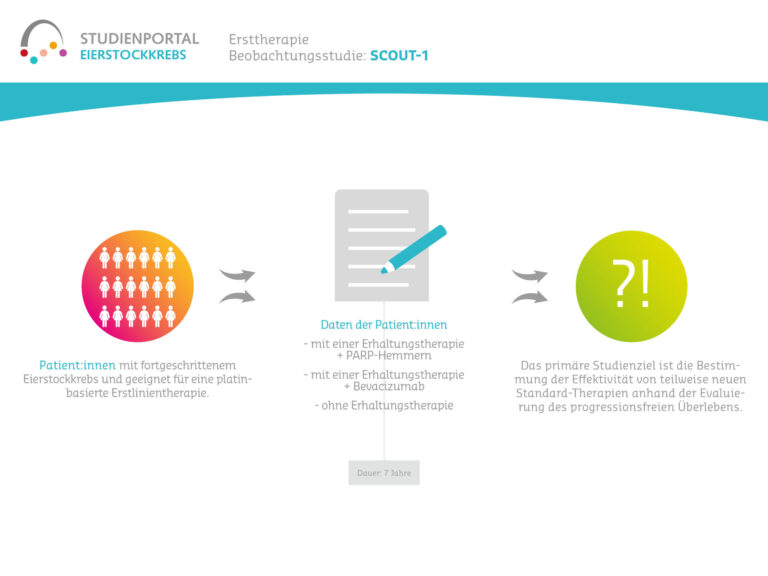
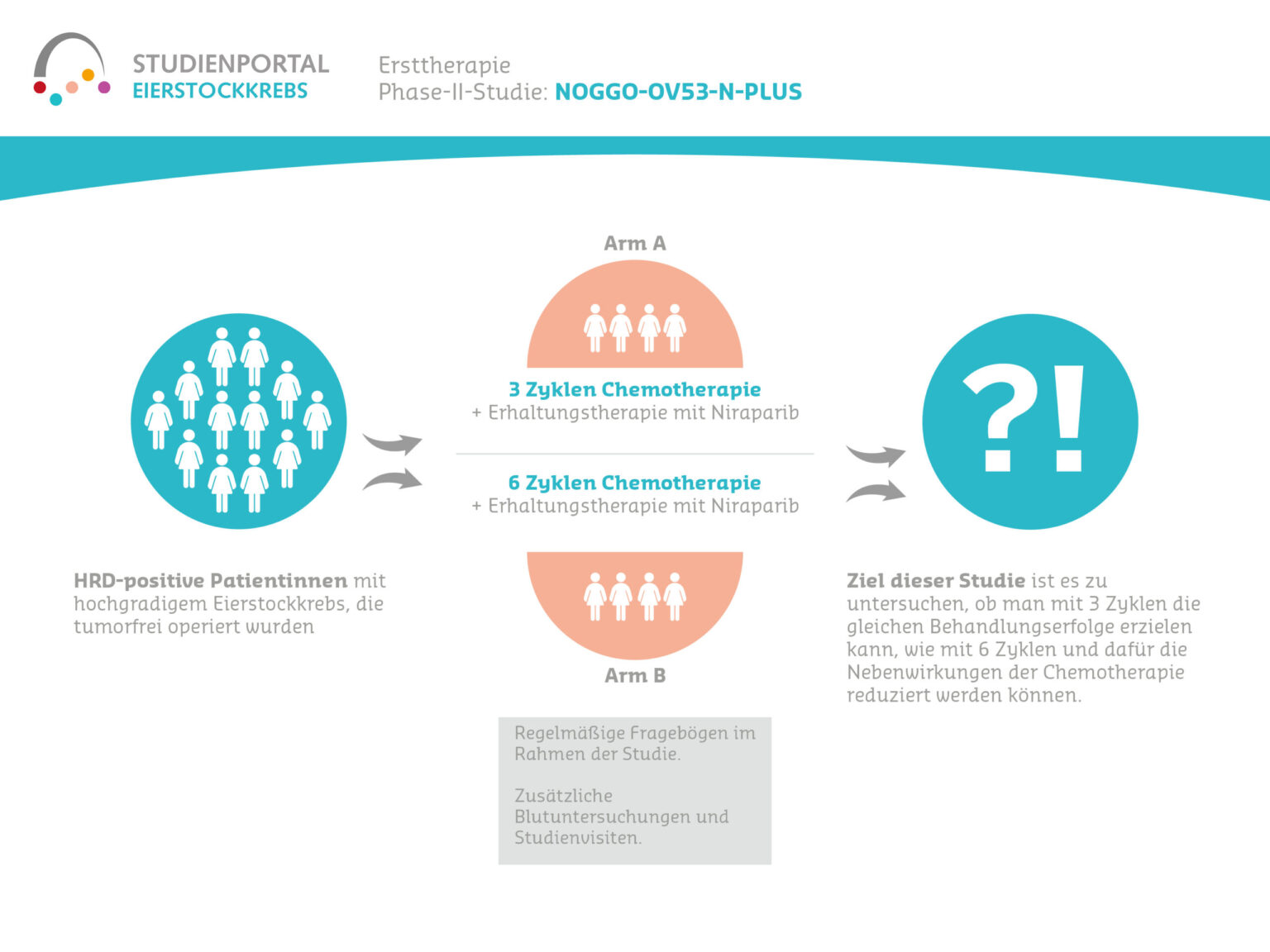
SCOUT-1, yumurtalık kanserli hastaların günlük rutininden klinik ve hasta tarafından bildirilen verileri toplamayı amaçlayan gözlemsel bir çalışma olup girişimsel olmayan bir çalışmadır. Uygun hastalar platin bazlı birinci basamak kemoterapi için uygun olan ve BRCA/HRD testi yapılması planlanan hastalardır. Gözlemsel çalışma 7 yıllık bir süre boyunca veri toplayacak, ancak tedavi sürecine müdahale etmeyecektir.
Bu çalışmada ne analiz ediliyor?
Yumurtalık kanseri olan hastaların çoğunluğu ileri evrede teşhis edilir. Debulking cerrahisinden (tümör dokusunun çıkarılması) elde edilen iyileşmiş sonuçlara ve platin bazlı birinci basamak kemoterapiye iyi yanıt alınmasına rağmen, yumurtalık kanserli hastaların çoğunda iki yıl içinde nüks görülmektedir. (Kaynak: S3 kılavuzu Malign yumurtalık tümörlerinin teşhisi, tedavisi ve sonrası bakımı, Mayıs 2022: Kılavuz programı)
Son iki yılda, özellikle takip bakımında yeni tedavi seçenekleri araştırılmış ve idame tedavisi kavramını içerecek şekilde genişletilmiştir. Sonuç olarak progresyonsuz sağkalım (yani bir denemeye katılım ile hastalığın ilerlemesi arasında geçen süre) iyileşmiştir. Örneğin, PARP inhibitörlerinin ilerlemiş yumurtalık kanseri ve BRCA mutasyonlarında etkinliği kanıtlanmıştır. PARP inhibitörleri kanser hücrelerinin DNA onarımını bozar ve böylece doğal kendini yok etme programını aktive eder. Bir BRCA mutasyonu, kanser gelişimini destekleyebilen değiştirilmiş genetik materyaldir. Çalışmalar, PARP inhibitörlerinin BRCA mutasyonu olmayan hastalarda da etkili olduğunu göstermiştir.
Bu yeni bulgulara dayanarak, PARP inhibitörlerinin birinci basamak idame tedavisinde kullanımı lehine güçlü bir tavsiye yayınlanmıştır. PARP inhibitörlerinin ruhsatının bu şekilde uzatılması, tanı ve tedavi önlemlerini, takip bakımını ve hastaların günlük bakımdaki algı ve ihtiyaçlarını etkileyebilir. Bu hususların çoğu çalışmada gözlemlenecektir.
Çalışmanın amacı nedir?
Çalışmanın birincil amacı, hastalığın seyri ve yeni teşhis edilmiş ileri evre yumurtalık kanserinin tedavisine ilişkin verileri belgelemektir. Bu veriler rutin tedavi sırasında toplanmaktadır. Amaç, progresyonsuz sağkalımı değerlendirerek bazı yeni standart tedavilerin etkinliğini belirlemektir.
Bu gözlemsel çalışma aynı zamanda Almanya’daki günlük koşullar altında yumurtalık kanserli hastaların tedavi şekilleri ve sonuçları hakkında yeni bilgiler sağlayacaktır. Hastaların etkinliği, beklentileri ve ihtiyaçları, moleküler test prosedürleri, seçim kriterleri ve standart tedavi dizilerinin tolere edilebilirliğine odaklanacaktır. Hastaların sağlık durumları ve yaşam kaliteleri hakkında kendilerinin doldurduğu hasta anketleri, hastalığın ve tedavinin hastalığın seyri üzerindeki etkisinin daha iyi anlaşılmasını sağlamayı amaçlamaktadır.
Çalışma nasıl organize edildi?
Hastalar yedi yıla kadar gözlemlenmektedir. Rutin doktor ziyaretleri sırasında hastanın tıbbi geçmişi ve mevcut tedavisine ilişkin veriler belgelenir ve bu verilerin bir kısmı çalışma veri tabanına aktarılır. Birinci basamak tedaviyi takip eden yıllarda toplanan tedavi verileri de aktarılacaktır. Çalışmaya katılım herhangi bir ek doktor ziyaretine yol açmamaktadır. Yaşam kalitesi ve tercih verileri bir anket kullanılarak hastaların kendileri tarafından elektronik olarak kaydedilmektedir, bu nedenle katılım için bir akıllı telefon, tablet veya bilgisayar gereklidir.
Herhangi bir risk var mı?
SCOUT-1 gözlemsel çalışmasında, rutin bakım dışında ek tıbbi riskler yoktur. Verilerin toplanması, saklanması, kullanılması ve iletilmesiyle ilgili gizlilik riskleri vardır. Bu riskler tamamen göz ardı edilemez ve daha fazla veri birbirine bağlanabildiğinde artar. Çalışmanın sponsoru, çalışma verilerini en son teknolojiye göre korumak için mümkün olan her şeyi yapmaktadır.
Katılım koşulları
Bu çalışmaya 18 yaş ve üzeri kadınlar katılabilir:
- yeni teşhis edilmiş ileri evre yumurtalık kanseri olan
- Platin bazlı birinci basamak tedavi için uygun
- tamamlanmış veya planlanan bir BRCA/HRD testi ile
Bununla birlikte, çalışmaya katılmak için karşılanması gereken başka kriterler de vardır. İlgilenen hastalar, bu çalışmanın kendileri için uygun olup olmadığını kontrol edebilecek bir çalışma merkezindeki araştırmacılarla konuşmalıdır.
Çalışmaya nerede katılabilirim?
Bu çalışma tarafından desteklenmektedir: