NOGGO ov54 - Scout 1
Beobachtungstudie zur Erfassung von Daten aus der Alltagsroutine von Patient:innen mit Ovarialkarzinom in der Ersttherapie
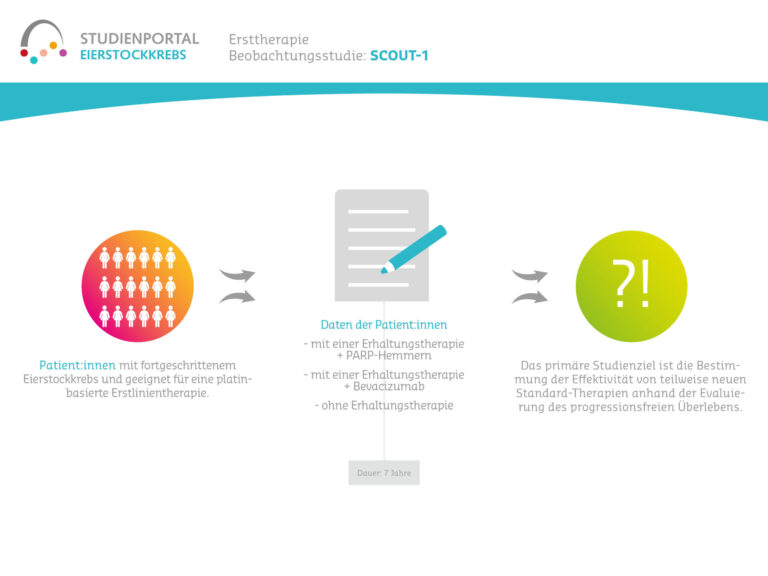
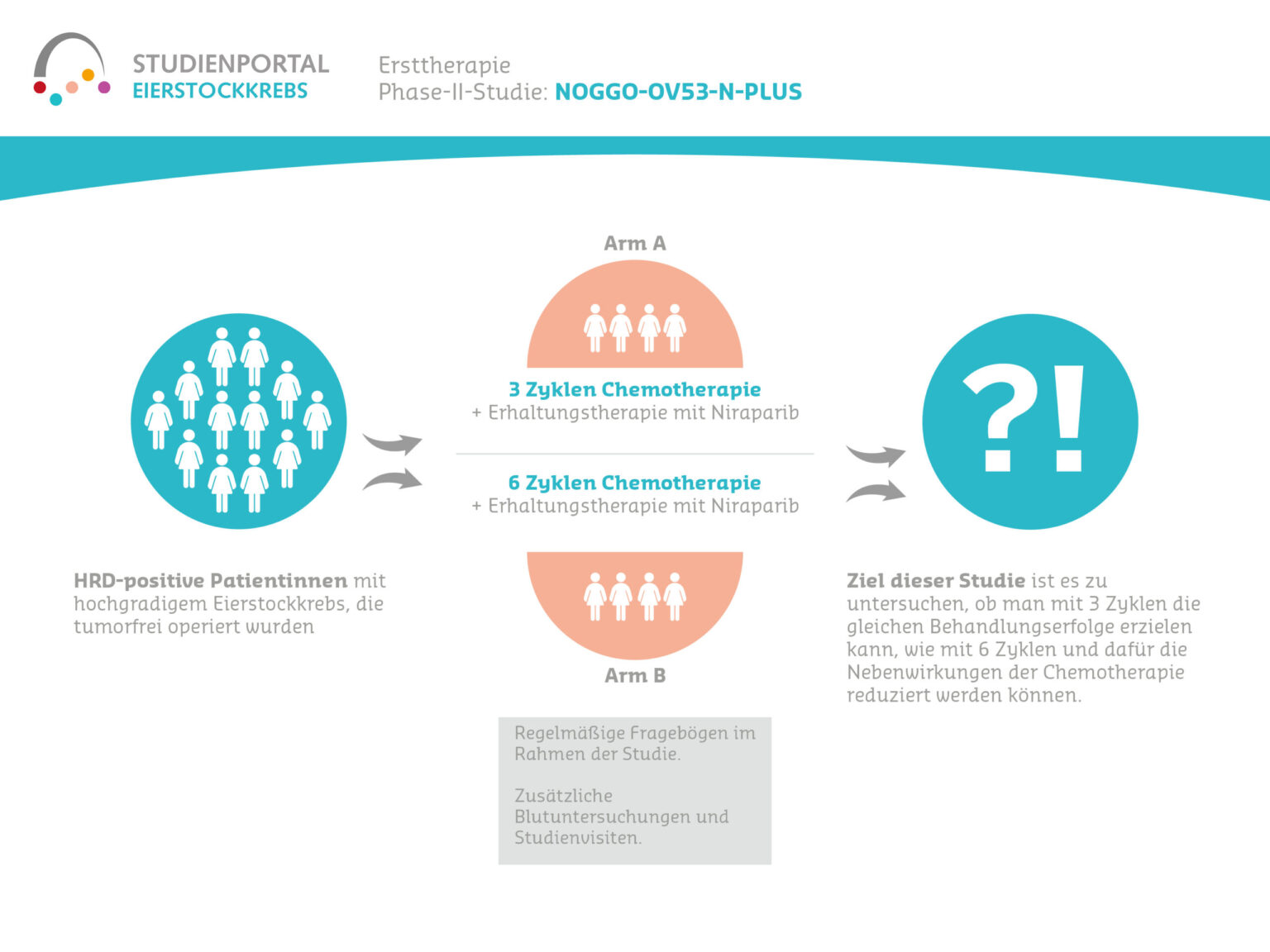
SCOUT-1 ist eine nicht-interventionelle Studie, eine sogenannte Beobachtungstudie mit dem Ziel, klinische und patient:innenberichtete Daten aus der Alltagsroutine von Patient:innen mit Ovarialkarzinom zu erfassen. In Frage kommen Patient:innen, die für eine Platin-basierte Erstlinien-Chemotherapie geeignet sind und für die eine BRCA/HRD-Testung geplant ist. Bei der Beobachtungsstudie werden über einen Zeitraum von 7 Jahren Daten erfasst, sie greift jedoch nicht in den Therapieverlauf ein.
Was wird in dieser Studie untersucht?
Der Großteil der Patient:innen mit einem Ovarialkarzinom wird im fortgeschrittenen Stadium diagnostiziert. Trotz verbesserter Resultate der Debulking-Operation (Entfernung des Tumorgewebes) und gutem Ansprechen auf die Platin-basierte Erstlinien-Chemotherapie erleiden die meisten Patient:innen mit Ovarialkarzinom innerhalb von zwei Jahren ein Rezidiv. (Quelle: S3-Leitlinie Diagnostik, Therapie und Nachsorge maligner Ovarialtumoren, Stand Mai 2022: Leitlinienprogramm)
In den letzten zwei Jahren wurden neue Behandlungsoptionen vor allem in der Nachsorge erforscht und um das Konzept der Erhaltungstherapie erweitert. Das progressionsfreie Überleben (also die Zeit zwischen einer Studienteilnahme und einem Fortschreiten der Krankheit) konnte dadurch verbessert werden. Zum Beispiel konnte bei fortgeschrittenem Eierstockkrebs und einer BRCA-Mutation die Wirksamkeit von PARP-Hemmern bewiesen werden. PARP-Hemmer stören die DNA-Reparatur der Krebszellen und aktivieren so das natürliche Selbstzerstörungsprogramm. Eine BRCA-Mutation ist verändertes Erbgut, welches eine Krebserkrankung begünstigen kann. Studien erbrachten auch einen Wirksamkeitsnachweis von PARP-Hemmern bei Patient:innen ohne BRCA-Mutation.
Auf Grundlage dieser neuen Erkenntnisse wurde eine starke Empfehlung für die Nutzung von PARP-Hemmern in der Erstlinien-Erhaltungstherapie ausgesprochen. Diese Zulassungserweiterung von PARP-Hemmern kann die diagnostischen und therapeutischen Maßnahmen, die Nachsorge sowie Vorstellungen und Bedürfnisse der Patient:innen im Versorgungsalltag beeinflussen. Die meisten dieser Aspekte werden in der Studie beobachtet.
Was ist das Ziel der Studie?
Das primäre Studienziel ist die Dokumentation von Daten zum Krankheitsverlauf und zur Behandlung des neu diagnostizierten fortgeschrittenen Eierstockkrebs. Diese Daten werden innerhalb der Routinebehandlung erhoben. Damit soll die Effektivität von teilweise neuen Standard-Therapien anhand der Evaluierung des progressionsfreien Überlebens ermittelt werden.
Diese Beobachtungsstudie soll zudem neue Einblicke in Behandlungsmuster und -ergebnisse von Patient:innen mit Eierstockkrebs unter Alltagsbedingungen in Deutschland liefern. Dabei stehen Effektivität, Erwartungen und Bedürfnisse der Patient:innen, molekulare Testabläufe, Selektionskriterien und Verträglichkeit von Standard-Therapieabfolgen im Fokus. Mit Patient:innenfragebögen, welche die Patient:innen zum Gesundheitszustand und zur Lebensqualität selbst auffüllen, soll der Einfluss der Erkrankung sowie zur Behandlung im Verlauf besser verstanden werden.
Wie ist der Ablauf der Studie?
Die Patient:innen werden bis zu sieben Jahre beobachtet. Während der Routinearztbesuche werden Daten zur Krankheitsgeschichte und zur aktuellen Therapie dokumentiert und ein Teil dieser Daten wird in die Studiendatenbank übertragen. Auch in den Folgejahren nach der Erstlinien-Therapie werden erhobene Therapie-Daten übertragen. Durch die Teilnahme an der Studie entstehen keine zusätzlichen Arztbesuche. Die Lebensqualitäts- und Präferenzdaten werden von den Patient:innen eigenständig mittels eines Fragebogens elektronisch erfasst, daher ist ein Smartphone, Tablet oder Computer für die Teilnahme notwendig.
Gibt es Risiken?
Im Rahmen der SCOUT-1-Beobachtungstudie gibt es keine zusätzlichen medizinischen Risiken, die außerhalb der routinemäßigen Behandlung liegen. Bei jeder Erhebung, Speicherung, Nutzung und Übermittlung von Daten bestehen Vertraulichkeitsrisiken. Diese Risiken lassen sich nicht völlig ausschließen und steigen, je mehr Daten miteinander verknüpft werden können. Der Sponsor der Studie tut alles, was nach dem Stand der Technik zum Schutz der Studiendaten möglich ist.
Teilnahmebedingungen
An dieser Studie können Frauen im Alter ab 18 Jahren teilnehmen:
- mit neu diagnostizierten fortgeschrittenem Eierstockkrebs
- für eine platin-basierte Erstlinientherapie geeignet
- mit einer erfolgten oder geplanten BRCA/HRD-Testung
Darüber hinaus gibt es aber auch noch weitere Kriterien, die für eine Teilnahme an der Studie erfüllt sein müssen. Interessierte Patient:innen sollten mit den Prüfärztinnen und Prüfärzten an einem Studienzentrum sprechen, welche prüfen können, ob diese Studie für sie in Frage kommt.
Wo kann ich an der Studie teilnehmen?
Diese Studie wird unterstützt von: