NIS Niraparib – NOGGO-ov45 – CAROLIN
Für Patientinnen mit platinsensitivem Eierstockkrebs, die keine Gegenanzeigen von Niraparib aufweisen
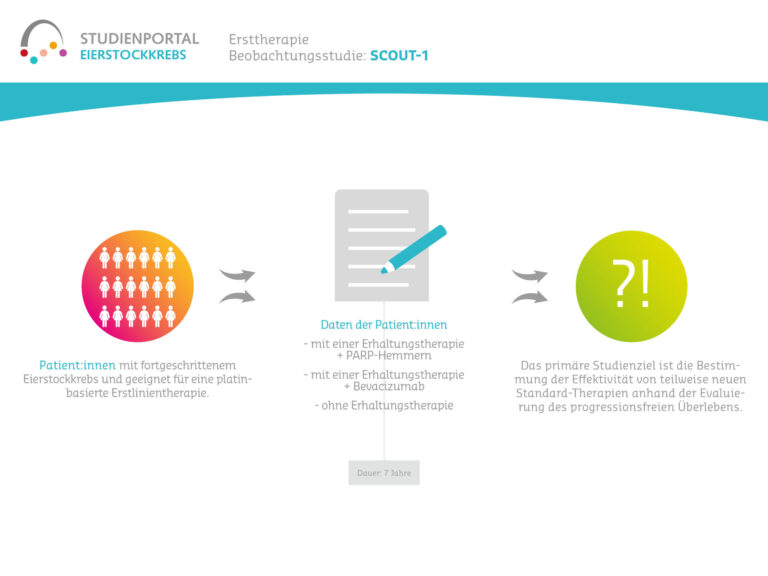
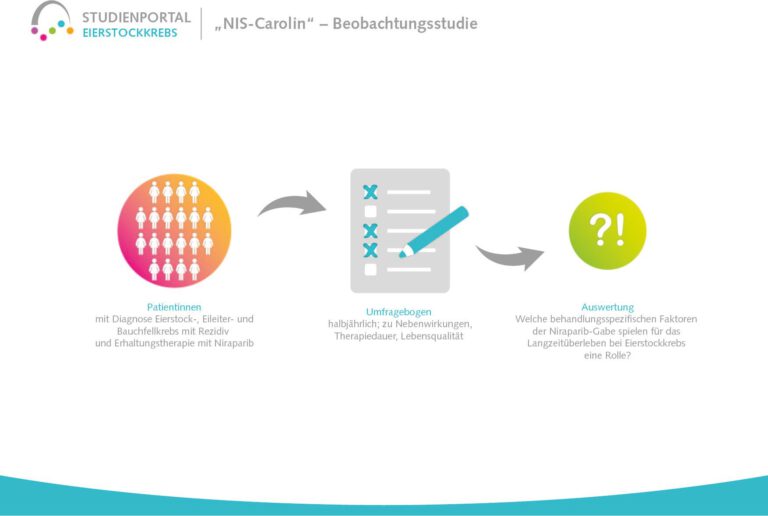
Diese nicht-interventionelle Beobachtungsstudie soll die Langzeittherapie mit Niraparib bei Patientinnen mit platinsensitivem Eierstockkarzinom, die eine Erstdiagnose oder bereits einen Rückfall (Rezidiv) erlitten haben, untersuchen und Faktoren identifizieren, die mit einem Langzeitüberleben verbunden sind. Niraparib ist ein sogenannter PARP-Inhibitor, der die Wirkung der Chemotherapie nach ihrem Abschluss verlängert, indem er die Reparaturmechanismen in den von der Chemotherapie geschädigten Krebszellen unterdrückt. Die beschädigten Zellen können sich dann nicht regenerieren, sondern sterben ab.
Was ist das Ziel der Studie?
Ziel ist es herauszufinden, welche typische Merkmale/Charakteristika im Hinblick auf die Krankheit, Therapie und Patientinnen mit einem Langzeitüberleben verbunden sind. Auch wird untersucht, welche behandlungsspezifischen Faktoren der Niraparib-Gabe (Dosis, Nebenwirkungen, Therapiedauer, Lebensqualität unter der Therapie) mit einem Langzeitüberleben korrelieren.
Wie ist der Ablauf der Studie?
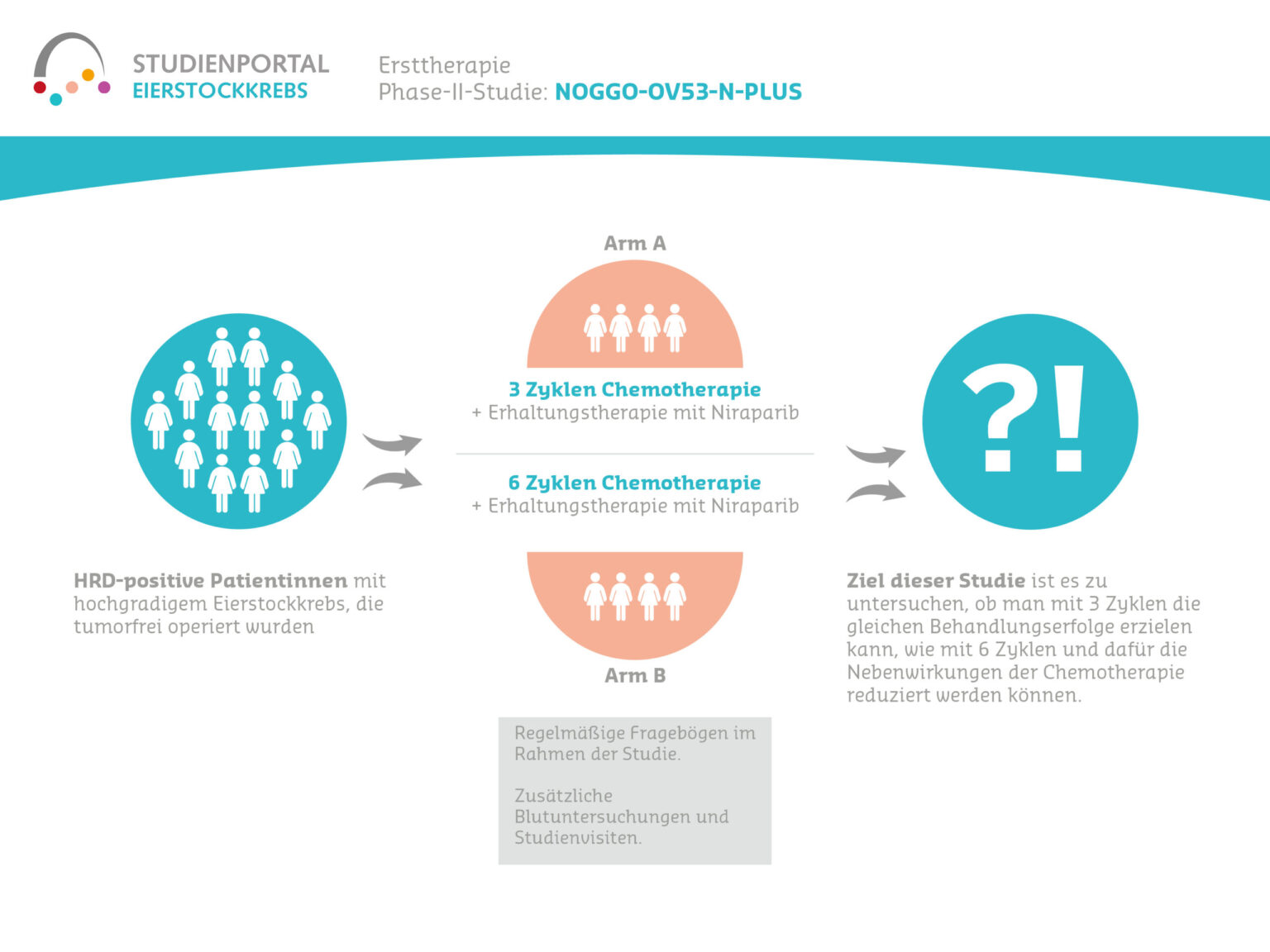
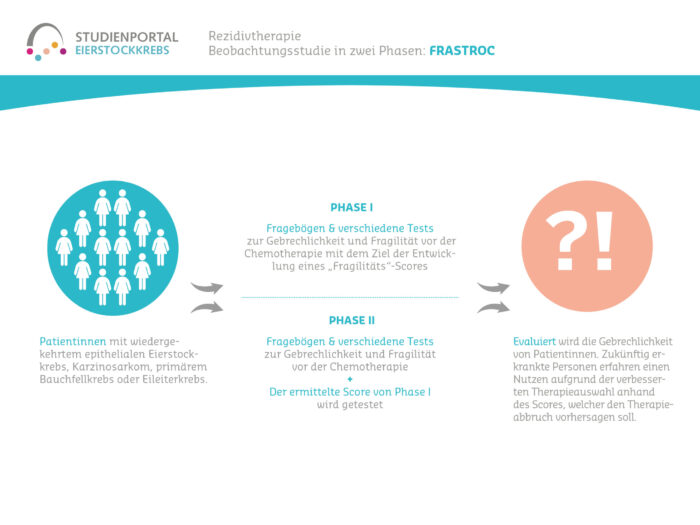
Es handelt sich um eine Beobachtungsstudie, bei der die Entscheidung für eine Behandlung mit Niraparib von Arzt und Patientin vor Studienbeginn getroffen wurde und die Therapie nach dem Standardregime erfolgt. Zu Beginn der Studie sowie danach alle sechs Monate werden die Daten der Patientinnen erhoben, und zwar bis zu acht Jahre nach Studieneinschluss.
Gibt es Risiken?
Es handelt sich um eine reine Beobachtungsstudie, d.h. die Patientinnen erhalten keine zusätzlichen Medikamente oder andere Behandlungsregimes. Insofern setzen sich die Studienteilnehmerinnen keinen zusätzlichen Risiken und Nebenwirkungen aus. Allerdings kann die Behandlung mit Niraparib, das in der Rückfallsituation bei Patientinnen mit Eierstockkrebs nach der Chemotherapie verschreiben wird, Nebenwirkungen haben, z.B. zu einem Mangel an Blutplättchen, Mangel an bestimmten weißen Blutkörperchen (neutrophile Granulozyten),Blutarmut, Bluthochdruck oder Fatique-Syndrom führen.
Teilnahmevoraussetzungen
An dieser Studie können Frauen mit Eierstock-, Eileiter- oder Bauchfellkrebs im Alter ab 18 Jahre teilnehmen, bei denen eine Erstdiagnose oder ein Rückfall vorlag (gesichert durch einen histologischen Befund) und bei denen durch die Chemotherapie ein Tumoransprechen erreicht wurde. Die Patientinnen müssen sich für die Erhaltungstherapie mit Niraparib eignen, dürfen also keine Gegenanzeigen aufweisen und in der Lage sein, selbständig und zuverlässig eine orale Medikation einzunehmen. Patientinnen, die Überempfindlichkeiten gegen das Präparat aufweisen, schwanger sind oder stillen, dürfen nicht an der Studie teilnehmen.
Wo kann ich an der Studie teilnehmen?
Diese Studie wird unterstützt von:
Das forschende Pharmaunternehmen GLAXOSMITHKLINE ist Partner dieser Studie.